*Passe o cursor sobre as espécies para acessar conteúdo teórico.
Agregados Supramoleculares







As moléculas de corantes e surfactantes sofrem auto-agregação apesar da repulsão devido a cargas semelhantes (corantes catiônicos) e mantem as cargas tanto quanto possível no agregado. As forças que mantêm as moléculas de corante juntas são ligação de hidrogênio, forças de van der Waals, forças de dispersão de London e outras forças de curto alcance, sendo predominante as interações hidrofóbicas.
Solventes próticos com alta constante dielétrica, como a água, são particularmente bons solvatadores de ânions e fazem ligação de hidrogênio com grupos polares não ionizados, o que interfere na solubilidade e no estado de agregação dos solutos. Assim, a estrutura da água determina sua polaridade com repercussões na sua afinidade de ligação e consequente solubilização ou indução de agregação dos solutos.
Em solução aquosa o corante azul de metileno encontra-se em equilíbrio entre as formas monômeros,
dímeros, trímeros e alguns agregados maiores. Em baixas concentrações do MB+ o equilíbrio
encontra-se deslocado para a forma monomérica e desloca-se para a forma agregada em
concentrações de corante acima de 25 μM.
Com o aumento da concentração do corante o equilíbrio vai se deslocando para a forma dimérica.
A condição de equilíbrio pressupõe a coexistência de 2 espécies que se interconvertem em velocidades iguais e cujas concentrações relativas variam conforme as condições do meio.
Com um maior aumento da concentração do corante o equilíbrio vai se deslocando ainda mais para a forma dimérica.
Quando um surfactante, em baixa concentração, é adicionado à água suas moléculas buscam se arranjar de modo a minimizar a área
de superfície em contato com a água. Em baixas concentrações, como por exemplo a de 1,5 mM para o SDS, os monômeros e pequenos agregados
do surfactante estarão em equilíbrio com uma monocamada na superfície da água.
Moléculas anfifílicas tendem a se agregar espontaneamente em meio aquoso objetivando excluir suas porções hidrofóbicas do contato com a água.
Todo surfactante possui uma concentração crítica, chamada de concentração micelar crítica (CMC) na qual o equilíbrio se desloca drasticamente dos monômeros e agregados pré-micelares
para micelas e que se caracteriza por drástica diminuição da tensão superficial da água. A CMC é típica de cada detergente e modulada pela força iônica do meio.
A CMC do SDS em água pura é 8 mM.
Micelas aquosas são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante na interface ar/água.
A saída de um monômero que integra uma micela ocorre na escala de tempo de milionésimo de segundos e sua recaptura ocorre a velocidades similares àquelas provindas
de processos controlados por difusão
(por volta de k = 108 – 109 mol L-1 s-1).
(por volta de k = 108 – 109 mol L-1 s-1).
Quando um surfactante, em baixa concentração, é adicionado à água suas moléculas buscam se arranjar de modo a minimizar a área de
superfície em contato com a água. Em baixas concentrações ( por exemplo a de 0,75 mM para o CTAB) os monômeros e pequenos agregados do surfactantes estarão em
equilíbrio com uma monocamada na superfície da água.
A polaridade da água a torna um excelente solvente para íons e um indutor da formação de agregados supramoleculares de surfactantes. Em solução aquosa, a CMC do CTAB é de 1mM . A estrutura molecular que determina o volume da cabeça e da cauda do detergente é a responsável pelo número de agregação .
A CMC vai depender da área da porção hidrofóbica do surfactante. Quanto maior essa área, menor a CMC.
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante na interface ar/água. A forma e tamanho da micela varia com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH, podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
O aumento da concentração de SDS, abaixo da CMC, e na presença de MB+ em baixa concentração, forma agregados mistos de corantes e surfactantes que favorece o
aumento da forma dimérica do MB+ em relação ao corante puro
Nessa condição observa-se o equilíbrio bastante deslocado para a forma dimérica e isso foi favorecido pelo abaixamento da CMC do SDS, conforme já foi demonstrado
por medidas de tensão superficial. Considerando o número de agregação do SDS como 60 nessa condição teremos 25 μM de micelas (mn=m/n) , exatamente a metade da concentração de MB+,
o que determina que o corante se associe aos pares às micelas.
Nessa condição a concentração de micelas também é de 25 μM, porem a concentração de MB é 150 μM o que significa 6 moléculas de MB por micela.
Portanto, nessa condição teremos todas as micelas ocupadas por agregados de MB e um excedente de monômeros e uns poucos agregados dispersos em solução.
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante
na interface ar/água. A forma e tamanho da estrutura micelar variam com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH,
podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante
na interface ar/água. A forma e tamanho da estrutura micelar variam com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH,
podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante
na interface ar/água. A forma e tamanho da estrutura micelar variam com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH,
podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante
na interface ar/água. A forma e tamanho da estrutura micelar variam com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH,
podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante
na interface ar/água. A forma e tamanho da estrutura micelar variam com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH,
podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante
na interface ar/água. A forma e tamanho da estrutura micelar variam com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH,
podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante
na interface ar/água. A forma e tamanho da estrutura micelar variam com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH,
podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante
na interface ar/água. A forma e tamanho da estrutura micelar variam com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH,
podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
Micelas aquosas de CTAB são entidades dinâmicas e a estrutura micelar está em equilíbrio com os monômeros da solução e com a monocamada de surfactante
na interface ar/água. A forma e tamanho da estrutura micelar variam com o tipo, concentração e composição do surfactante, além da temperatura, força iônica e pH,
podendo adquirir configuração esférica, cilíndrica ou planar (discos ou bicamadas).
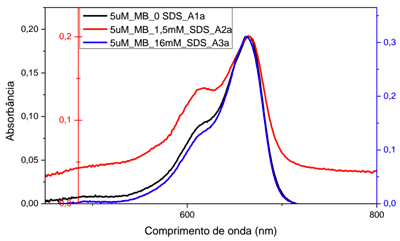
Representação do equilíbrio



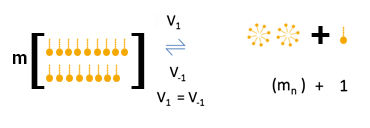
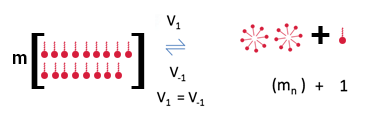
*As quantidades de moléculas não correspondem à realidade, mas representam proporções. .